Hemoglobina y Mioglobina son dos proteínas extremadamente fundamentales para el intercambio y transporte de gases de pulmón al tejido.
Mioglobina
- Proteína monomérica del músculo esquelético que almacena oxígeno como una reserva contra la privacidad del mismo.
- Polipéptido de 153 aa
- Rica en hélices α , 8 en total.
- El oxígeno es almacenado para la liberación del mismo cuando hay una privación de O2 para que las mitocondrias lo utilicen en la síntesis aeróbica de ATP.
- La superficie de la mioglobina es rica en aa que tienen R laterales polares, pero su interior contiene R laterales no polares, excepto Excepto His F8 y E7.
- Hasta estructura terciaria
Hemoglobina
- Proteína tetramérica de los eritrocitos, transporta O2 hacia los tejidos y favorece el transporte de CO2 y protones hacia a los pulmones
- Misma estructura secundaria y terciaria que la mioglobina. Puede decirse que son 4 mioglobinas
- Compuesto de dos subunidades: α y β. Las β semejan a las de la mioglobina
- Sus propiedades alostéricas dependen de su estructura cuaternaria
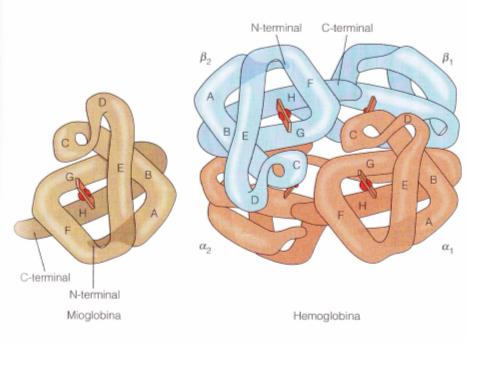
Hemoglobina y Mioglobina
Hemoglobina:
- Se une a 4 O2, uno por cada tetrámero por medio del enlace cooperativo-*
- Hasta estructura cuaternaria
Enlace/unión cooperativo: Hb puede enlazar 4 O2, por molécula, una por cada hemo. Una molécula de O2 entra con más facilidad si hay una molécula ya enlazada y así sucesivamente. O sea, la 1er molécula de O2 batalla para entrar porque rompe los puentes salinos, que posteriormente se vuelven a formar, la 2da batalla menos rompiendo dichos puentes y así sucesivamente. Entre más O2 más se rompen los puentes salinos. Al romper los puentes salinos también rompe carbamatos.
*Los puentes salinos se dan entre: carbamatos, entre cadenas e intercadenas.
*El alveolo es el lugar con más oxígeno en todo el cuerpo.

Saturación de Oxígeno
Estructura T: sin O2, es tensa porque aún tiene los puentes salinos. Baja afinidad
Estructura R: Durante la transición a R, la subunidad α2β2 rota 15° respecto al α1β1. Alta afinidad
- Tras liberar O2 en los tejidos, la Hb transporta el CO2
- El 15 % será en forma de carbamato y el 85% en forma de bicarbonato (este bicarbonato regresará a ácido carbónico)
- Los carbamatos se forman con los nitrógenos del amino terminal de las cadenas polipeptídicas y cambian la carga de los aminos terminales (de la proteína) de + a – (originalmente es positiva), favoreciendo la formación de puentes salinos entre cadenas α β.
- La Hb tiene 4 aminos terminales, entonces transporta 4 CO2 en forma de carbamato.
- De cada 4 O2, 1 se va a la mioglobina y si ésta ya tiene, entonces los 4 se van al metabolismo oxidativo.
Cambios conformacionales de la Hb:
- Cambios conformacionales. Rompe los puentes salinos de Hb para incorporar oxígeno
- La unión al O2 el grupo hemo se desplaza 0.6 nanómetros y se alinea. Esto es para que el Oxígeno lo reconozca, para que acceda al grupo hemo y termina alejándose para evitar interacción del hemo con la histidina distal
- El dímero α, β giran 15° por Oxígeno, este es un rearreglo espacial.
Tipos de Hb
Desoxihemoglobina: une un protón por cada 2 O2 liberado, contribuyendo a la capacidad de amortiguación de la sangre
Metahemoglobina: Su grupo hemo es férrico Fe+3 en vez de ferroso Fe+2, por lo tanto no transporta O2.
- La enzima metahemoglobina reductasa convierte al férrico en ferroso, por lo tanto si ésta la tenemos en baja proporción tendremos metahemoglobinas con férrico.
- Las sulfonamidas convierten de Fe+2 Fe+3 , normalmente están en solventes inhalados
- Mutación en la histidina proximal F8, no hay sitio de unión para el grupo hemo y es sustituída por una tirosina
Hemoglobina S: presente en anemia de células falciformes, el eritrocito presenta forma de hoz alargada.
- Tiene la valina (no polar) en lugar de ácido glutámico (polar -) de la subunidad β, ocurre por mutación
- Las paredes adhesivas hidrofóbicas permiten que los aa no polares se mantengan en no contacto con el agua, adoptando esa forma globular. Entonces si cambio un aa no polar por uno polar, cambiará la estructura de la proteína, por su afinidad al agua, por lo tanto se “desnaturalizará la proteína”, exponiendo sus aa no polares al agua. Para proteger a esos aa no polares del agua se le va a pegar otra hemoglobina y así sucesivamente, generando un “parche pegajoso”
Implicaciones biomédicas
- Mioglobinuria.- Aplastamiento de músculo, mioglobina en orina (rojo oscuro). Mb en plasma en IAM. daño muscular más común.
- Anemia.- Reducción en los eritrocitos, síntesis alterada de Hb (def. de Fe), menor producción de eritrocito
- Talasemia.- Ausencia parcial o total de 1 o más cadenas α o β. (αo o βo) ó (α+ o β+)
- Hemoglobina glicada: marcador que indicará el control glicémico del eritrocito en 3 meses. La glicación es la unión de la glucosa a la histidina y glicina.
Oxígeno
Enlaces:
Referencias
Hemoglobina Mioglobina: https://upload.wikimedia.org/wikipedia/commons/6/66/Comparaci%C3%B3_hemoglobina_mioglobina.jpg
Saturación de Oxígeno: https://upload.wikimedia.org/wikipedia/commons/8/8a/Oxyhaemoglobin_dissociation_curve.png
Oxígeno: https://upload.wikimedia.org/wikipedia/commons/b/b9/Capa_electr%C3%B3nica_008_Ox%C3%ADgeno.svg

No hay comentarios:
Publicar un comentario